| версия для печати | |||
Научные открытия
Григорьев И.В., Уланова Е.А., Артамонов И.Д. Белковый состав смешанной слюны человека: механизмы психофизиологической регуляции // Вестник РАМН. 2004. № 7. С. 36-47.
Белковый состав смешанной слюны человека:
механизмы психофизиологической регуляции
1Григорьев И.В., 2Артамонов И.Д., 3Уланова Е.А.
1Российский научный центр восстановительной медицины и курортологии МЗ РФ,
2Институт биоорганической химии им. М.М.Шемякина и Ю.А.Овчинникова РАН,
3Витебский государственный медицинский университет
Введение
В прошедшие десять лет наблюдался сильный всплеск внимания к изучению слюны и её свойств. Многочисленные данные, полученные в этой области науки, позволяют сделать вывод, что слюна человека представляет собой уникальную субстанцию, имеющую большие потенциальные возможности для использования в фундаментальных исследованиях и в медицинской диагностике. Наибольшее внимание в настоящее время уделяется изучению перспектив анализа слюны в диагностических целях. Это обусловлено целым рядом причин. Так, использование слюны может быть не только дополнительным методом в клинических исследованиях, но и имеет много преимуществ по сравнению с анализом крови и мочи: сбор слюны прост и удобен для случаев неклинических окружающих условий; он безболезненный; риск заражения медперсонала значительно меньше, чем при работе с кровью; содержание некоторых молекул (например, определённых гормонов, антител и лекарств) в слюне отражает их концентрацию в крови [36]. Также слюна может быть источником для изучения ДНК человека и находящихся в организме микробов. Высказывается мнение, что расширение использования слюны в клиническом анализе поможет ускорить переход от диагностики заболеваний к наблюдению за здоровьем [58]. Высоки потенциальные возможности для использования слюны с целью выявления системных заболеваний [38] и локальных патологий [42]. Наличие определённых корреляций между расстройствами разных физиологических систем и функциональной активностью слюнных желёз дало повод некоторым исследователям называть эти железы «зеркалом болезней» [54]. Мы, в свою очередь, полагаем, что есть все основания рассматривать слюну (особенно смешанную слюну, которая является результатом активности всех слюнных желёз) как «зеркало» психофизиологического состояния организма [2, 3].
Несмотря на большой объём анатомо-физиологических данных о слюнных железах и их секреторных выделениях, остаётся нерешённым до конца вопрос о том, как именно работает механизм, который управляет формированием биохимического состава слюны. В настоящее время значительная часть исследователей склоняется к выводу о решающей роли психоэмоциональных факторов в этих процессах [4, 15, 17, 18, 21, 27, 31, 32, 40, 44, 56, 57].
Одним из наиболее плодотворных направлений является исследование корреляций психоэмоционального состояния и содержания белков в слюне. В своих экспериментах мы обнаружили, что психоэмоциональное состояние человека контролирует белковый состав смешанной слюны [2, 3]. В этой статье мы представляем: 1) краткое обобщение современных данных о белках слюны; 2) основные результаты наших исследований по влиянию психоэмоционального состояния на белковый состав слюны; 3) описание ключевых элементов предполагаемого психофизиологического механизма, который управляет формированием белкового состава слюны человека.
Биохимический состав слюны. Белки слюны
Как известно, формирование слюны происходит с помощью трёх пар больших слюнных желез (околоушных/gl. parotis, подчелюстных/gl. submaxillares, подъязычных/gl. sublingules) и большого количества (600-1000) малых слюнных желёзок, локализованных на слизистой оболочке губ, языка, дёсен, нёба, щёк, миндалин и носоглотки. Каждая из этих желёз образует свой собственный слюнной секрет, который выделяется в ротовую полость и участвует в формировании «конечной» субстанции – смешанной слюны.
Смешанная слюна выполняет многообразные функции: пищеварительную, минерализующую, очищающую, защитную, бактерицидную, иммунную, гормональную и др.; в связи с чем она имеет сложный биохимический состав, в формировании которого участвуют разнообразные белки, липиды (холестерин и его эфиры, свободные жирные кислоты, глицерофосфолипиды и т.д.), стероидные соединения (кортизол, эстрогены, прогестерон, тестостерон, дегидроэпиандростерон, андростерон, 11-ОН-андростенедион и др.), углеводы (олигосахаридные компоненты муцинов, свободные гликозаминогликаны, ди- и моносахариды), ионы (Na+, K+, Ca2+, Li+, Mg2+, I-, Cl-, F- и т.д.), небелковые азотсодержащие вещества (мочевина, мочевая кислота, креатин, аммиак, свободные аминокислоты), витамины (С, В1, В2, В6, Н, РР и т.д.), циклические нуклеотиды и другие соединения. В слюне обнаружены также в относительно небольшом количестве лейкоциты, бактерии и части слущивающихся клеток эпителиальной ткани. Ежедневно у человека выделяется 0,5-2 литра слюны. Свыше 90 % всей массы слюнного секрета приходится на воду [1].
Важнейшим компонентом слюны являются белковые соединения, значительную часть которых условно можно разделить по своим функциональным свойствам на три группы: участвующие в пищеварительных процессах, связанные с местным иммунитетом и выполняющие регуляторные функции.
Белки, участвующие в пищеварительных реакциях, представлены гидролитическими ферментами, основным из которых является α-амилаза (расщепляет α-1-4-глюкозидные связи гомополисахаридов до мальтозы и небольших олигосахаридов), которая может составлять до 10% всех белков слюны. Кроме амилазы в состав слюны входят такие пищеварительные ферменты как: мальтаза, гиалуронидаза, трипсиноподобные ферменты, пепсиноген, пептидазы, эстеразы, липазы, нуклеазы, пероксидазы, кислые и щелочные фосфатазы, лактопероксидаза и т.д. Показано, что часть этих ферментов секретируется слюнными железами (напр., амилаза и лактопероксидаза), ряд других поступает из крови (напр., пепсиноген) или имеют «смешанное» происхождение (напр., кислая и щелочная фосфатазы) и некоторые являются продуктами метаболизма лейкоцитов или микробов (напр., мальтаза, альдолаза) [1].
Иммунные факторы слюны представлены в основном иммуноглобулином А и в меньшей степени IgG, IgM [23] и IgE [14]. Неспецифическими защитными свойствами обладают следующие белки слюны. Лизоцим, низкомолекулярный белок, гидролизует β-1-4-гликозидную связь полисахаридов и мукополисахаридов, содержащих мурамовую кислоту, в клеточных стенках микроорганизмов [6]. Лактоферрин участвует в различных реакциях защиты организма и регуляции иммунитета [33]. Малые фосфопротеины, гистатины и статерины, играют важную роль в антимикробном действии [29]. Цистатины являются ингибиторами цистеиновых протеиназ и могут выполнять защитную роль при процессах воспаления в ротовой полости [9]. Муцины – крупные гликопротеины, которые в основном обеспечивают вязкую природу слюны – запускают специфическое взаимодействие между стенкой бактериальных клеток и комплементарными галактозидными рецепторами на мембране эпителиальных клеток [62]. Подобные свойства обнаружены также у амилазы [52], фибронектина и β2-микроглобулина [59].
Третью крупную группу белков слюны составляют биологически активные вещества, регулирующие функции разнообразных систем организма. Так слюнные железы выделяют целый ряд веществ с гипо- и гипертензивным действием: калликреин, гистамин, ренин, тонин и др. Белковые факторы слюны человека, влияющие на гемопоэз, представлены эритропоэтином, фактором гранулоцитоза, тимоциттрансформирующим и колониестимулирующим факторами. Широко представлены в слюне разнообразные ростовые регуляторы: факторы роста нервов, эпидермиса, мезодермы, фибробластов; инсулин-подобный фактор роста и др. Большинство биологически активных факторов слюны являются пептидами или гликопротеинами. Для многих из них (факторы роста нервов и эпидермиса, паротин, калликреин, тонин и др.) доказано, что они выделяются из слюнных желёз как в ротовую полость, так и в кровеносное русло [7].
Низкомолекулярные белки слюны с молекулярной массой < 3 кДа образуются в основном путём протеолиза пролин-обогащённых белков, гистатинов и статеринов [45].
В слюне человека также обнаружены различные нейропептиды: метионин-энкефалин, субстанция Р, β-эндорфин [46], нейрокинин А, нейропептид Y, вазоактивный желудочный полипептид, кальцитонин-генерируемый пептид [16].
Одним из важнейших методов анализа белкового состава слюны является электрофорез. Использование для этой цели электрофореза в 12%-м полиакриламидном геле дало разные результаты у различных исследовательских групп. Shiba A. et al. [55] получил 22 белковые полосы в препаратах из смешанной слюны, Oberg S.G. et al. [43] – 29 полос, Rahim Z.H. et al. [47] – 20 полос. Современная приборная база позволяет обнаружить до 30-40 различных белковых фракций в одномерных электрофореграммах слюнных препаратов. При этом индивидуальные отличия белковых электрофореграмм слюны оказываются, как правило, в концентрации отдельных белков, а не в их количестве. Повторный сбор слюны одних и тех же людей показал сохраняющееся постоянство белкового спектра у них [53].
Непсихические факторы, влияющие на белковый состав слюны
Несмотря на большое количество научных данных о слюнных железах и слюне, до сих пор не ясно, как именно работает физиологический механизм, регулирующий белковый состав слюны.
Как известно, слюнные железы имеют богатую иннервацию волокнами вегетативной нервной системы [1]. Поэтому естественно предполагать, что нервная система является основным регулятором функций слюнных желёз и, в конечном итоге, белкового состава слюны. Данные об участии нервной системы и психоэмоциональных факторов в этой регуляции будут обсуждены ниже.
Не относящиеся непосредственно к активности нервной системы различные физиологические и физические факторы, как мы предполагаем, являются второстепенными в отношении формирования белкового состава слюны. Как показывает большое число исследований, физические и физиологические факторы или не имеют ярко выраженного влияния на весь белковый состав слюны или же изменяют содержание в слюне одного или нескольких белков. Так, например, возраст [51], пол [10], циркадные ритмы [43], пищевые эффекты [22, 43] не имеют значительных влияний на белковый состав слюны. С другой стороны обнаружены изменения уровня определённых белков на фоне: заболеваний (кариеса – IgA [34], пародонтоза – ингибитор металлопротеазы-1 [24], псориаза – лизоцим [19], воспаления полости рта – фактор роста эпидермиса [28]), курения – фактор роста эпидермиса [13], физической нагрузки – IgA [39]. Вместе с тем, например, при кариесе среднестатистический уровень крупных фракций белков в слюне не меняется [26].
К числу других факторов, которые могли бы оказывать влияние на концентрацию определённых белков слюны, также относят: месячные циклы и беременность [50], медикаментозное лечение [25], белковый полиморфизм [10], популяционные особенности человека, наследственность, специфические различия в белок-микробном взаимодействии, синергичное или антагоничное взаимодействие между белками [48].
Однако, влияние вышеописанных разнообразных факторов на белковый состав слюны пока недостаточно исследовано.
Вторым после нервной системы универсальным физиологическим элементом, участвующим в регуляции формирования белкового состава слюны, считается гемато-саливарный барьер [1].
Предполагается, что на синтез различных белков в слюнных железах оказывают регуляторное воздействие гормональные вещества, такие как пролактин, андрогены, тироидные гормоны и кортикостероиды, влияющие на секреторные клетки через гемато-саливарный барьер [49]. Однако, в целом вопрос о работе гемато-саливарного барьера пока мало изучен.
Влияние психики на биохимический состав слюны
Факт воздействия психоэмоционального состояния на величину слюнного потока был неоднократно подтверждён как в начале ХХ века [5], так и в его конце [12, 20]. Однако, вопрос о влиянии психики на биохимический (и в частности, белковый) состав слюны оставался до сих пор открытым. В силу разных причин не удавалось сформировать ясную и адекватную теорию в этой области психофизиологии. Отчасти такая ситуация была связана с методическими трудностями (сложность учёта одновременного воздействия разнообразных физиологических факторов, а также объективной оценки сиюминутного психоэмоционального состояния человека и т.п.). Поэтому, как правило, для оптимизации изучения влияния разных психоэмоциональных состояний на физиологию слюноотделительных процессов используют различные стандартные психические и психофизические нагрузки (умственные тесты, игровые ситуации и другие психофизические нагрузки).
В ходе этих исследований было обнаружено, что определённые виды психоэмоционального стресса вызывают изменение в слюне уровня ингибиторов моноаминоксидазы А и В [17], калликреина [56], катехоламинов [44], кортизола [32], интенсивности свободно радикальных процессов и активности антиоксидантных ферментов [4]. Также было показано, что содержание секреторного иммуноглобулина А снижалось при эмоциональном переживании [40] и хроническом стрессе [27], но повышалось при эмоциональном раздражение [18], остром стрессе и позитивном настроении [27]. В связи с такой реакцией уровня IgA высказывались предположения о влиянии настроения на иммунитет, но серьёзных работ в этом направлении и развития этой очевидной идеи пока не проведено [57].
Кроме вышеупомянутого, было обнаружено, что концентрация кортизола в слюне детей коррелирует с их поведенческими реакциями [21]. Уровень тестостерона в слюне детей согласуется с их способностью к обучаемости [31], а также с некоторыми депрессивными состояниями у взрослых [15]. На то, что идея использования стероидных гормонов для оценки состояний психики остаётся весьма привлекательной для исследователей, указывает наличие нескольких десятков публикаций за последнее десятилетие, большинство из которых посвящено влиянию настроения на содержание кортизола и тестостерона в слюне.
До сих пор в большинстве случаев исследователи пытались оценить влияние психоэмоционального состояния на уровень определённого вещества в слюнном секрете. Мы обнаружили в своих исследованиях, что наблюдение одновременно уровня многих белков с помощью электрофореза в полиакриламидном геле очень информативно для выявления корреляции между психоэмоциональным состоянием и белковым составом слюны [2, 3].
Метод электрофоретического анализа белкового состава слюны
Слюна у обследуемых лиц собиралась (путём обычного сплёвывания в чистый химический стакан) утром до еды в количестве до 200 мкл. После чего она центрифугировалась 10 мин при 10000 об/мин и хранилась в морозильной камере при -20°С.
Для денатурации белков слюны в каждую полученную пробу добавляли 1/2 (от её объёма) буфера, содержащего 100 мМ Трис (рН 7,5), 7% додецилсульфата натрия, 2% меркаптоэтанола, 0,02% бромфенолового голубого, 20% глицерина. Смесь тщательно встряхивали и инкубировали 10 мин при 20°С. 20 мкл из каждого полученного таким образом препарата слюны использовали для электрофоретического анализа в полиакриламидном геле по методу Laemmli U. K. [37]. Электрофорез осуществлялся в 12% полиакриламидном геле толщиной 0,75 мм и размерами 10х8 см.
Для определения локализации белков, гель после электрофореза инкубировали 1 час в окрашивающем растворе (25% этиловый спирт, 10% ледяная уксусная кислота, 2 мг/мл кумаси синий), затем дважды промывали дистиллированной водой и инкубировали 1-2 часа в обескрашивающем растворе (25% этиловый спирт, 10% ледяная уксусная кислота) до отчётливого проявления полос белковых фракций.
Слюна для анализа собиралась у людей, имевших различные психоэмоциональные состояния: контрольная группа – люди без расстройств психической сферы (n=85); группы стационарных пациентов с депрессивным синдромом разной глубины и вида (на фоне психических /n=90/ и соматических /n=80/ заболеваний), тревожным расстройством (n=4), шизофренией (n=36), наркозависимостью (n=30), паническим синдромом (n=4), расстройством личности (n=10). Исследовались также воздействия положительных и отрицательных естественных и искусственно-вызванных (размышление о приятном и неприятном) психоэмоциональных состояний.
Особенности различных видов белкового состава смешанной слюны
и их предполагаемая связь с активностью регуляторных вегетативных центров
Сопоставление электрофоретических картин белкового состава смешанной слюны и психоэмоционального состояния, на фоне которого были взяты пробы, позволило нам обнаружить, что между ними существует отчётливое соответствие. Оказалось, что белковый состав смешанной слюны чутко реагирует на изменение психоэмоционального состояния, при этом происходит специфическая трансформация белкового состава [2, 3].
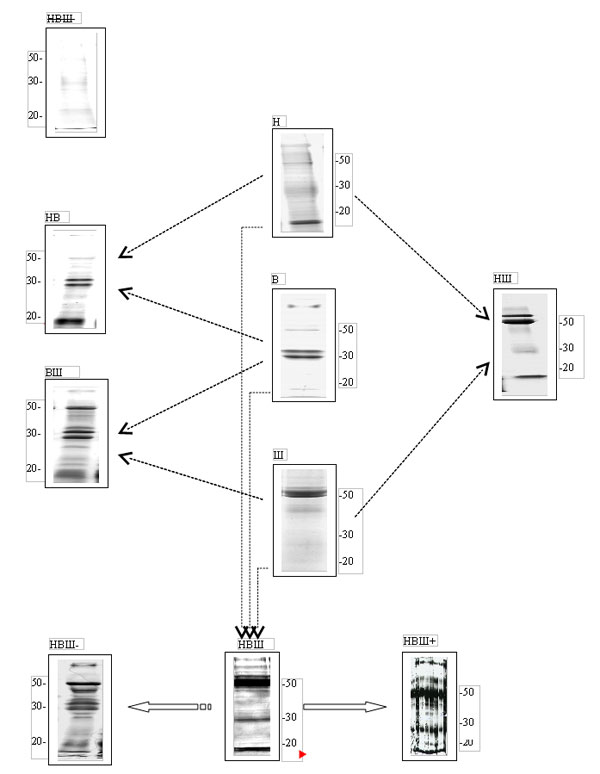 | |
| Рис. 1. Схема предполагаемой связи между активностью регулирующих слюнные железы вегетативных нервных центров (Н – нижнее слюноотделительное ядро, В – верхнее слюноотделительное ядро, Ш – шейный симпатический узел) и белковым составом смешанной слюны, регистрируемом с помощью электрофореза в полиакриламидном геле. Числа сбоку картинок указывают молекулярные массы в килодальтонах. Подробное описание всей схемы представлено в тексте статьи. |
Изученные нами электрофоретические картины белкового состава смешанной слюны (в общей сложности более 1200 шт.) могут быть условно распределены на восемь основных групп, которые различаются между собой определенным соотношением преобладающих белковых фракций. Мы предполагаем, что такое число наблюдаемых типов белкового состава смешанной слюны определяется количеством возможных сочетаний совместной активности трёх вегетативных нервных центров, регулирующих работу больших слюнных желез.
На рис. 1 представлена одна из возможных простейших схем связи совокупной активности этих трёх нервных центров с картиной белкового состава слюны, наблюдаемой с помощью электрофореза в полиакриламидном геле. Мы условно предположили, что активность каждого из данных центров в отдельности контролирует в слюне уровень белков с определённой молекулярной массой:
-
при активности только симпатического шейного центра (Ш), в ротовую полость выделяются преимущественно белки с молекулярной массой в области 50-60 кДа;
-
при активности только верхнего слюноотделительного ядра (В), в ротовую полость выделяются преимущественно белки с молекулярной массой в области 30-35 кДа;
-
при активности только нижнего слюноотделительного ядра (Н), в ротовую полость выделяются преимущественно белки с молекулярной массой в области < 30 кДа.
Из этих допущений следует, что:
-
совместная активность верхнего слюноотделительного ядра и шейного центра при неактивном нижнем слюноотделительном ядре (ВШ) должна сопровождаться преобладанием в смешанной слюне белков в областях 30-35 кДа и 50-60 кДа;
-
совместная активность нижнего и верхнего слюноотделительных ядер при неактивном шейном центре (НВ) должна сопровождаться преобладанием в смешанной слюне белков с молекулярной массой ≤ 30 кДа;
-
совместная активность нижнего слюноотделительного ядра и шейного центра при неактивном верхнем слюноотделительном ядре (НШ) должна сопровождаться преобладанием в смешанной слюне белков с молекулярной массой 50-60 кДа и < 30 кДа;
-
совместная активность всех трех вегетативных нервных центров (НВШ), регулирующих слюнные железы, будет сопровождаться высокой концентрацией в смешанной слюне белков с молекулярной массой 50-60 кДа, 30-35 кДа и < 30 кДа;
-
отсутствие активности в нижнем и верхнем слюноотделительных ядрах и в шейном центре (
НВШ) будет сопровождаться сильным уменьшением уровня белков по всему наблюдаемому диапазону молекулярных масс.
Внутри каждой из восьми описанных групп белкового состава смешанной слюны существует определённое разнообразие дополнительных деталей.
Перечисленные варианты совокупной активности трех вегетативных нервных центров, регулирующих большие слюнные железы, представляют собой, как мы думаем, основной элемент контроля белкового состава смешанной слюны.
Мы предполагаем, что двумя другими важными факторами управления белкового состава смешанной слюны являются гемато-саливарный барьер и малые слюнные железы. Хотя эти факторы играют, скорее всего, модулирующую роль, внося дополнительные детали в картину белкового состава смешанной слюны, формируемую секреторной активностью больших слюнных желез под действием трех упомянутых вегетативных центров.
Гемато-саливарный барьер, как предполагается, также регулируется вегетативной нервной системой [8], под контролем которой он, вероятно, может изменять свою проницаемость для определенных белков, усиливая их транспорт из крови в слюну. Эта область пока слабо изучена.
Секреции малых слюнных желез богаты белком [61], но вопросы о регуляции этих желез и о вкладе их секреций в смешанную слюну также не достаточно изучены.
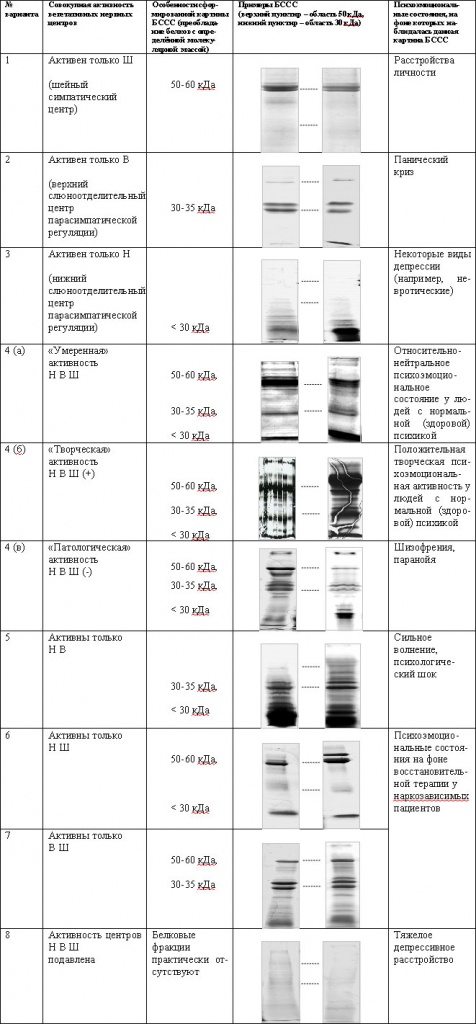 | |
| Таблица 1. Предполагаемые основные типы картин белкового состава смешанной слюны, соответствующие восьми возможным вариантам совокупной активности трех вегетативных нервных центров (Ш – симпатический в шейном отделе позвоночника, В и Н – соответственно верхний и нижний слюноотделительные парасимпатические центры в головном мозге), регулирующих большие слюнные железы. |
Как было упомянуто выше, в своих исследованиях мы обнаружили, что картина белкового состава смешанной слюны зависит от характера психоэмоционального состояния человека. В таблице 1 представлена информация о том, на фоне каких психоэмоциональных состояний наблюдаются те или иные картины белкового состава смешанной слюны.
Наиболее часто наблюдаемой картиной белкового состава смешанной слюны является вариант НВШ (табл. 1, 4а). Он характерен для относительно-нейтрального (спокойного) психоэмоционального состояния человека с обычной здоровой психикой. Этот вариант условно обозначен как «умеренная» активность центров НВШ. При наблюдении отдельных людей в течение разных промежутков времени (дни, недели, месяцы) мы обнаружили, что картина белкового состава смешанной слюны практически не меняет своего вида, если слюна берётся в относительно нейтральном (спокойном, естественном) для данного человека психоэмоциональном состоянии. Изменения белкового состава смешанной слюны в таких случаях, как правило, очень незначительны и связаны преимущественно с колебаниями уровня одной-двух, редко больше, белковых фракций. Эти результаты подтверждаются в частности исследованиями Oberg et al. [43].
При усиленной положительной творческой психоэмоциональной активности, белковый состав смешанной слюны значительно обогащается белком, особенно в области 50-60 кДа (табл. 1, 4б). Мы предполагаем, что в этих состояниях усиливается деятельность симпатической ветви нервной системы. Этот вариант условно обозначен нами как «творческая» активность центров НВШ. Аналогичные картины белкового состава смешанной слюны мы наблюдали также в случаях положительных естественных эмоций, характерных для так называемого «приподнятого» или радостного настроения.
С другой стороны, при заболеваниях шизофренического характера может также происходить увеличение белков по всему наблюдаемому диапазону молекулярных масс и в частности в областях 50-60 кДа и 30-35 кДа (табл. 1, 4в). Однако в данных случаях в этих областях наблюдается специфическая деформация электрофоретических треков в виде элипсоидных форм и дугообразных изгибаний белковых полос. Мы предполагаем, что это может быть связано или с какой-то специфической модификацией белков из слюнных желез, или же с присутствием в слюне проникших из крови определенных белковых веществ. Этот вариант нами обозначен условно как «патологическая» активность центров НВШ.
Все прочие представленные варианты картин белкового состава смешанной слюны (табл. 1, варианты 1-3, 5-8) наблюдались при определенных естественных психоэмоциональных нагрузках, связанных преимущественно с психопатологическими состояниями. Среди этих наблюдений одним из наиболее интересных является то, что различные формы депрессии вызывают заметное уменьшение уровня белков в смешанной слюне (табл. 1, варианты 3, 8). Последние данные представлены в нашей более ранней публикации [3], где описана корреляция между уровнем белковой фракции вблизи 55 кДа и показаниями шкалы депрессии теста ММPI. Для выяснения деталей влияния различных других психопатологических состояний на белковый состав смешанной слюны требуются дальнейшие кропотливые исследования.
При анализе белкового состава смешанной слюны на фоне разнообразных психоэмоциональных состояний нами было обнаружено, что белковая фракция вблизи области 55 кДа является наиболее крупной у подавляющего большинства исследованных людей. Вместе с тем, уровень этой фракции в разных случаях может изменяться в очень широком диапазоне, по всей вероятности, на один-два порядка.
По нашим наблюдениям, большое разнообразие картин белкового состава смешанной слюны можно разделить, как уже говорилось, на ограниченное число групп с определенными признаками. Границы между этими группами не являются жесткими, т.к. существуют промежуточные виды белкового состава смешанной слюны с общими («междугрупповыми») признаками. Такое разнообразие имеет свою «изюминку» – оно отражает индивидуальные психофизиологические нюансы исследуемого человека и представляет естествоиспытателю крайне интересную и важную возможность для изучения психологической сферы. К сожалению, подробное рассмотрение разнообразия белкового состава смешанной слюны на фоне широкого спектра психоэмоциональных состояний выходит за рамки настоящей статьи, поэтому перейдем к рассмотрению данных, описывающих ключевые элементы психофизиологического механизма, осуществляющего контроль белкового состава слюны.
Элементы психофизиологического механизма,
регулирующего белковый состав смешанной слюны человека
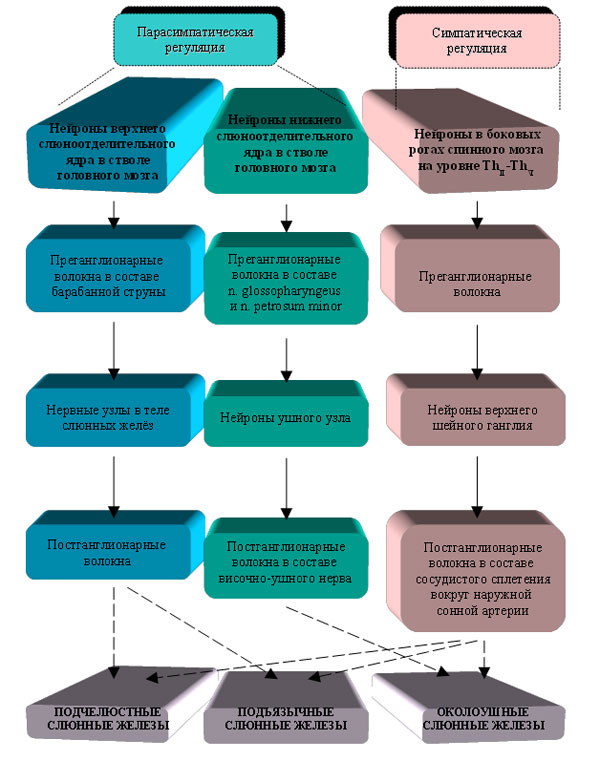 | |
| Рис. 2. Вегетативная регуляция больших слюнных желёз. |
Как было упомянуто выше, основными элементами психофизиологической регуляции белкового состава смешанной слюны человека считаются центры вегетативного контроля больших слюнных желёз. Эти железы иннервируются симпатическими и парасимпатическими нервами (рис. 2) [1]. Парасимпатическая регуляция подчелюстных и подъязычных желёз осуществляется по рефлекторной дуге, включающей в себя: нейроны верхнего слюноотделительного ядра в стволе головного мозга; преганглионарные волокна, идущие в составе барабанной струны к подчелюстным и подъязычным узлам, которые расположены в теле каждой из соответствующих желез. От этих ганглиев отходят постганглионарные волокна к клеткам слюнных желёз. Нижнее слюноотделительное ядро продолговатого мозга передаёт регуляторные импульсы к околоушным железам через преганглионарные волокна n. glossopharyngeus и n. petrosum minor, а затем через нейроны ушного узла по волокнам височно-ушного нерва.
Симпатическая иннервация слюнных желёз включает следующие звенья. Нейроны, от которых отходят преганглионарные волокна, располагаются в боковых рогах спинного мозга на уровне ThII-ThVI. Эти волокна подходят к верхнему шейному ганглию, где заканчиваются на эфферентных нейронах, дающих начало аксонам, достигающим околоушных, подчелюстных и подъязычных желёз (в составе сосудистого сплетения, окружающего наружную сонную артерию).
В настоящий момент различными исследователями накоплено значительное количество данных о том, какие биохимические посредники могут участвовать в переносе регуляторных нервных импульсов внутрь секреторных клеток больших слюнных желез.Симпатические волокна, иннервирующие слюнные железы, содержат в своих симпатических окончаниях, как предполагается, преимущественно два нейромедиатора, норадреналин и адреналин [1]. В научной литературе имеется больше данных по исследованию норадреналиновой регуляции слюнных желез.
Считается, что в регуляции работы слюнных желез наибольшую роль играет парасимпатическая иннервация, так как каждая их клетка богато оплетена веточками парасимпатических волокон. Предполагается, что несколько парасимпатических нейронов конвергирует на одну клетку. Основным переносчиком парасимпатического сигнала к секреторным клеткам слюнных желез является ацетилхолин [1]. Другим важным нейромедиатором парасимпатических импульсов, рецепторы к которому локализованы в основном в мукозных клетках, является вазоактивный кишечный пептид (VIP) [35, 41].
Парасимпатические нервные окончания, контактирующие с кровеносными капиллярами в слюнных железах, содержат, как считается, преимущественно два нейромедиатора пептидной природы: VIP и субстанцию Р (SP) [41]. Предполагается, что последние участвуют в контроле проницаемости гемато-саливарного барьера.
Кроме этого, в нервных волокнах в слюнных железах были обнаружены и другие нейромедиаторы (аденозин трифосфат, гамма-аминобутировая кислота, гистамин, инсулин [30], нейрокинин А, кальцитонин ген-связанный пептид [16]), но их участие во внутриклеточной сигнализации секреторных клеток практически не изучено.
Внутриклеточная сигнализация, которая инициируется нервными импульсами в секреторных клетках слюнных желез, включает в себя следующие звенья: сигнальная молекула (нейромедиатор) → клеточный рецептор (трансмембранная белковая молекула) → регуляторный G-белок → специфический фермент → вторичный низкомолекулярный переносчик сигнала → воздействие на определённые внутриклеточные процессы → выделение секреторного материала (в нашем случае – определённых белков) во внеклеточную среду.
В таблице 2 представлены молекулярные посредники, которые, как предполагается, обеспечивают работу главных ветвей внутриклеточной сигнализации в секреторных клетках больших слюнных желез.
| Таблица 2. Молекулярные посредники внутриклеточной сигнализации в секреторных клетках слюнных желез (составлено с использованием [11, 30]). |
 |
Независимо от того, действует ли VIP- и SP-сигнализация преимущественно на гемато-саливарный барьер или же одновременно и на секреторные клетки, очевидно, что нервная регуляция больших слюнных желез в конечном итоге реализуется по трём внутриклеточным сигнальным путям. В первом случае внутри секреторной клетки увеличивается содержание диацилглицерола, активатора протеин киназы С, и инозитол 1,4,5-трифосфата, который повышает уровень ионов Са2+ в цитоплазме. Во втором – возрастает внутриклеточный уровень сАМР, а в третьем – концентрация сАМР наоборот снижается. В двух последних случаях происходит соответственно усиление или угнетение активности сАМР-зависимой протеин киназы. Эти три внутриклеточных сигнальных механизма на завершающем этапе приводят к экзоцитозу секреторных гранул, содержащих определённые белковые компоненты.
Общим обстоятельством для всех этих сигнальных путей является то, что участвующие в них клеточные рецепторы относятся к семейству семи-доменных трансмембранных белков, которые передают сигнал внутрь клетки через GTP-связывающие белки (G-белки).
Анализ научной литературы показывает, что в настоящее время отсутствует ясная картина о конкретных особенностях пула рецепторов на поверхности секреторных клеток слюнных желез человека, хотя и существуют многочисленные данные об изучении этих рецепторов в слюнных железах человека и разнообразных животных. Выяснение реального распределения нейромедиаторных рецепторов известных семейств, таких как М(1,2,3,4,5), α1(А,В,D), α2(А,В,С), β(1,2,3) и др., в определённых видах (серозных, мукозных и смешанных) секреторных клеток той или иной слюнной железы поможет понять более точно работу ключевого регуляторного звена «нейромедиатор → секреторная клетка → белковая секреция» в механизме контроля больших слюнных желез.
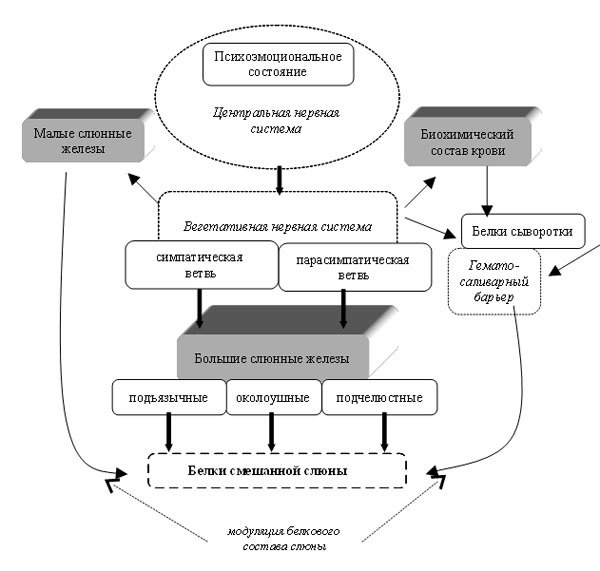 | |
| Рис. 3. Принципиальная схема физиологического механизма, связывающего психоэмоциональное состояние человека с белковым составом его смешанной слюны. |
Резюмируя всё описанное выше, можно сказать, что существуют общие для всех людей анатомо-физиологические элементы управления белковым составом смешанной слюны. На рис. 3 представлена принципиальная схема психофизиологического механизма, регулирующего белковый состав смешанной слюны человека.
Определённые эмоции (психоэмоциональные состояния) приводят к специфической активации трёх центров вегетативного контроля слюнных желез. Из этих центров передаются нервные импульсы, управляющие формированием белковой секреции в секреторных клетках больших слюнных желёз. Возможно, что одновременно из тех же центров параллельно идут сигналы, которые модулируют белковый состав слюны с помощью изменения активности малых слюнных желез и проницаемости гемато-саливарного барьера.
Представленная нами в этой статье картина предполагаемой психофизиологической регуляции белкового состава смешанной слюны не является законченной. Остаются неясными многие вопросы. Несомненно, что данная область биологии нуждается в серьезном внимании и кропотливой исследовательской работе.
Заключение
К вопросам в области психофизиологической регуляции слюнных желез, которые требуют дальнейших исследований, можно, в частности, отнести:
- Каков механизм, с помощью которого разные психоэмоциональные состояния воздействуют на активность различных вегетативных центров, регулирующих большие слюнные железы?
-
Имеется ли дифференциация активности в структуре тел центров вегетативной регуляции слюнных желез, которая распределяется по нескольким аксонам, или импульсы идут одним суммарным сигналом от каждого из этих центров?
-
Регулируют ли вегетативные центры одинаково правую и левую слюнную железу в каждой из трёх пар больших слюнных желез или есть определённые различия?
-
Какой вклад в формировании белкового состава смешанной слюны вносят: каждая из больших слюнных желез в отдельности; гемато-саливарный барьер; малые слюнные железы?
- Как распределены разные типы рецепторов, участвующие в нервном контроле, на секреторных клетках различных слюнных желёз и секрецию каких белков регулируют эти рецепторы?
-
Какие биологические функции выполняют белки, секретируемые в слюну на фоне разных психоэмоциональных состояний (т.е. какие медико-биологические свойства приобретает слюна под действием различных эмоций)?
Перспективы. Как видно из представленных выше данных, психоэмоциональное состояние может достаточно сильно воздействовать на содержание в слюне целого спектра разных белковых веществ. Большинство этих белков контролируют определённые физиологические процессы. Если предположить, что, аналогично слюнным, и другие железы подвержены столь же сильному влиянию психоэмоциональных состояний (мы думаем, что это будет со временем доказано), то воздействие психической активности на биохимический фон (и как следствие, на физиологию) организма может оказаться достаточно масштабным.
В этой связи обращает на себя внимание тот факт, что при некоторых психических расстройствах (например, депрессивном синдроме) лечение соматических заболеваний традиционными медикаментами малоэффективно. Учёные, сделавшие эти наблюдения, пока не смогли дать ясного объяснения данному явлению [60]. Результаты наших исследований, возможно, предоставляют реальную основу для понимания причин. Как мы показали ранее [3], при депрессивном синдроме кардинально меняется биохимическая среда (белковый состав) секреторных выделений из слюнных желёз, вследствие чего могут существенно меняться различные метаболические цепочки в организме. Соответственно, можно предположить, что действие лекарственных препаратов на таком фоне меняется по сравнению с ситуацией, когда психоэмоциональное состояние характеризуется нормальной активностью.
Полученные нами факты о психофизиологической регуляции слюнных желез позволяют предположить, что фундаментальная наука о человеке (психология, [психо]физиология, нейрофизиология, эндокринология, клеточная биология, биохимия) и практическое здравоохранение (общая медицина и психиатрия) могут получить новые ценные возможности при использовании методов биохимического анализа слюны.
Так в области фундаментальных исследований метод анализа белков слюны позволяет изучать, как психическая активность воздействует на:
-
секреторные процессы (работу желёз) в организме;
-
синтез белка в секреторных клетках;
-
работу генома секреторных клеток.
В широком смысле описанный метод предоставляет возможности для исследования механизмов, с помощью которых осуществляется влияние со стороны различных психоэмоциональных состояний (нормализующих или дестабилизирующих) на функционирование разных физиологических систем.
Метод анализа слюны позволяет средствами биохимии изучать психическую активность в различных состояниях сознания и когнитивной деятельности. Учитывая, что в настоящее время психофизиология и нейрофизиология используют преимущественно биофизические методы, которые в определённом смысле обременительны для испытуемых людей, данный биохимический метод может значительно увеличить возможности исследования психической сферы человека.
Настоящий метод может быть в большой степени интересен как базовая технология для изучения влияния психоэмоциональных состояний на биохимические процессы в организме человека. Метод может быть использован как «полигон» для подготовки аналогичных исследований крови и других биологических сред человека.
В сфере здравоохранения данный метод может быть применен для разработки средств биохимической (объективной) оценки психологических особенностей личности, что представляет определённое значение для:
-
общей медицины при необходимости учёта психофизиологического состояния пациента, что могло бы позволить организовать наиболее целесообразную терапию (как известно, на фоне разных психоэмоциональных состояний действие лекарств различается [60]);
-
психиатрии при диагностике психических расстройств (слюна отражает нарушения в психической сфере; следует отметить, что поиск биологических индикаторов психопатологий является актуальной медицинской проблемой).
Авторы выражают сердечную благодарность директору НИИ нормальной физиологии им. П.К.Анохина, академику К.В.Судакову за ценные рекомендации по содержанию настоящей статьи.
Работа поддержана Региональным общественным фондом содействия отечественной медицине (грант № С-01-2003).
ЛИТЕРАТУРА
1. Lac G. Saliva assays in clinical and research biology // Pathol. Biol. (Paris) 2001 49:8 660-7.
2. Tabak L.A. A revolution in biomedical assessment: the development of salivary diagnostics // Dent. Educ. 2001 65:12 1335-9.
3. Lawrence H.P. Salivary markers of systemic disease: noninvasive diagnosis of disease and monitoring of general health // J. Can. Dent. Assoc. 2002 68:3 170-4.
4. Nagler R.M., Hershkovich O., Lischinsky S., Diamond E., Reznick A.Z. Saliva analysis in the clinical setting: revisiting an underused diagnostic tool // J. Investig. Med. 2002 50:3 214-25.
5. Seifert G. Salivary glands and the organism-interrelations and correlating reactions // Laryngorhinootologie 1997 76:6 387-93.
6. Григорьев И.В., Уланова Е.А., Ладик Б.Б. Некоторые особенности белкового спектра смешанной слюны у пациентов с депрессивным синдромом // Клиническая лабораторная диагностика. 2002. № 1. С. 15-18.
7. Григорьев И.В., Николаева Л.В., Артамонов И.Д. Психоэмоциональное состояние человека влияет на белковый состав слюны // Биохимия. 2003. Т. 68. № 4. С. 501-503.
8. Бабаева А. Г., Шубникова Е. А. Структура, функция и адаптивный рост слюнных желез. М., Московский университет, 1979. 190 с.
9. Hajeer A.H., Balfour A.H., Mostratos A., Crosse B. Toxoplasma gondii: detection of antibodies in human saliva and serum // Parasite. Immunol. 1994. 16 (1): 43-50.
10. Brummer-Korvenkontio H., Lappalainen P., Reunala T., Palosuo T. Detection of mosquito saliva-specific IgE and IgG4 antibodies by immunoblotting // J. Allergy. Clin. Immunol. 1994. 93 (3): 551-555.
11. Покидова Н.В., Бабаян С.С., Журавлёва Т.П., Ермольева З.В. Химические и физико-химические свойства лизоцима человека // Антибиотики. 1974. 19 (8): 721-724.
12. Kirstila V., Tenovuo J., Ruuskanen O., Nikoskelainen J., Irjala K., Vilja N. Salivary defense factors and oral health in patients with common variable immunodeficiency // J. Clin. Immunol. 1994. 14 (4): 229-236.
13. Jensen J.L., Xu T., Lamkin M.S., Brodin P., Aars H., Berg T., Oppenheim F.G. Physiological regulation of the secretion of histatins and statherins in human parotid saliva // J. Dent. Res. 1994. 73 (12): 1811-1817.
14. Aguirre A., Testa-Weintraub L.A., Banderas J.A, Haraszthy G.G., Reddy-M.S., Levine M.J. Sialochemistry: a diagnostic tool?// Crit. Rev. Oral. Biol. Med. 1993. 4 (3-4): 343-350.
15. Wu A.M., Csako G., Herp A. Structure, biosynthesis, and function of salivary mucins // Mol. Cell Biochem. 1994. 137 (1): 39-55.
16. Scannapieco F.A., Torres G., Levine M.J. Salivary alpha-amylase: role in dental plaque and caries formation // Crit. Rev. Oral. Biol. Med. 1993. 4 (3-4): 301-307.
17. Vanden-Abbeele A., Courtois P., Pourtois M. The antiseptic role of saliva // Rev. Belge. Med. Dent. 1992. 47 (3): 52-58.
18. Сукманский О.И. Биологически активные вещества слюнных желез. Киев, Здоровье. 1991.
19. Perinpanayagam H.E., Van-Wuyckhuyse B.C., Ji Z.S., Tabak L.A. Characterization of low-molecular-weght peptides in human parotid saliva // J.Dent.Res. 1995. 74 (1):345-350.
20. Pikula D.L., Harris E.F., Dasiderio D.M., Fridland G.H., Lovelace J.L. Methionine enkephalin-like, substance P-like, and beta-endorphin-like immunoreactivity in human parotid saliva // Arch. Oral. Biol. 1992. 37 (9): 705-709.
21. Dawidson I., Blom M., Lundeberg T., Theodorsson E., Angmar-Mansson B. Neuropeptides in the saliva of healthy subjects // Life Sci. 1997 60:4-5 269-78
22. Shiba A., Shiba K.S., Suzuki K. Analysis of salivary proteins by thin layer sodium dodecylsulphate polyacrylamide gel electrophoresis // J. Oral. Rehabil. 1986. 13 (3): 263-271.
23. Oberg S.G., Izutsu K.T., Truelove E.L. Human parotid saliva protein composition: dependence on physiological factors // Am. J. Physiol. 1982. 242 (3): G231-236.
24. Rahim Z.H., Yaakob H.B. Electrophoretic detection of salivary alpha-amylase activity // J. Nihon. Univ. Sch. Dent. 1992. 34 (4): 273-277.
25. Schwartz S. S., Zhu W. X., Sreebny L. M. Sodium dodecil sulphate-polyacrylamide gel electrophoresis of human whole saliva // Arch. Oral. Biol. 1995. 40 (10): 949-958.
26. Salvolini E., Mazzanti L., Martarelli D., Di Giorgio R., Fratto G., Curatola G. Changes in the composition of human unstimulated whole saliva with age // Aging (Milano) 1999 11:2 119-22.
27. Banderas-Tarabay JA, Zacarias-D-Oleire I.G., Garduno-Estrada R., Aceves-Luna E., Gonzalez-Begne M. Electrophoretic analysis of whole saliva and prevalence of dental caries. A study in Mexican dental students // Arch. Med. Res. 2002 33:5 499-505.
28. Guinard J.X., Zoumas-Morse C., Walchak C. Relation between parotid saliva flow and composition and the perception of gustatory and trigeminal stimuli in foods // Physiol. Behav. 1997 31 63:1 109-18.
29. Kugler J., Hess M., Haake D. Secretion of salivary immunoglobulin A in relation to age, saliva flow, mood states, secretion of albumin, cortisol, and catecholamines in saliva // J. Clin. Immunol. 1992. 12 (1): 45-49.
30. Hayakawa H., Yamashita K., Ohwaki K., Sawa M., Noguchi T., Iwata K., Hayakawa T. Collagenase activity and tissue inhibitor of metalloproteinases-1 (TIMP-1) content in human whole saliva from clinically healthy and periodontally diseased subjects // J. Periodontal. Res. 1994. 29 (5): 305-308.
31. Gasior-Chrzan B., Falk E.S. Lysozyme and IgA concentrations in serum and saliva from psoriatic patients // Acta Derm. Venereol. 1992. 72 (2): 138-140.
32. Ino M., Ushiro K., Ino C., Yamashita T., Kumazawa T. Kinetics of epidermal growth factor in saliva // Acta Otolaryngol. Suppl. Stockh. 1993. 500: 126-130.
33. Bergler W., Petroianu G., Metzler R. Disminucion del factor de crecimiento epidermico en la saliva en pacientes con carcinoma de la orofaringe // Acta. Otorrinolaringol. Esp. 1992. 43 (3): 173-175.
34. Mackinnon L.T., Hooper S. Mucosal (secretory) immune system responses to exercise of varying intensity and during overtraining // Int. J. Sports. Med. 1994. 3: S179-183.
35. Hu Y., Ruan M., Wang Q. A study of parotid salivary proteins from caries-free and caries-active people by high performance liquid chromatography // Zhonghua Kou Qiang Yi Xue Za Zhi 1997 32:2 95-8.
36. Salvolini E., Di Giorgio R., Curatola A., Mazzanti L., Fratto G. Biochemical modifications of human whole saliva induced by pregnancy // Br. J. Obstet. Gynaecol. 1998 105:6 656-60.
37. Henskens Y.M., van-der-Weijden F.A., van-den-Keijbus P.A., Veerman E.C., Timmerman M.F., van-der-Velden U., Amerongen A.V. Effect of periodontal treatment on the protein composition of whole and parotid saliva // J. Periodontol. 1996. 67 (3): 205-212.
38. Rudney J.D. Does variability in salivary protein concentrations influence oral microbial ecology and oral health? // Crit. Rev. Oral. Biol. Med. 1995. 6 (4): 343-367.
39. Sabbadini E., Berczi I. The submandibular gland: a key organ in the neuro-immuno-regulatory network? // Neuroimmunomodulation 1995 2:4 184-202.
40. Павлов И.П. Двадцатилетний опыт объективного изучения высшей нервной деятельности (поведения) животных. С.-Петербург, 1923.
41. Gemba H., Teranaka A., Takemura K. Influences of emotion upon parotid secretion in human // Neurosci. Lett. 1996 28 211:3 159-62
42. Bergdahl M., Bergdahl J. Low unstimulated salivary flow and subjective oral dryness: association with medication, anxiety, depression, and stress // J. Dent. Res. 2000 79:9 1652-8.
43. Doyle A., Hucklebridge F., Evans P., Clow A. Salivary monoamine oxidase A and B inhibitory activities correlate with stress // Life Sci. 1996 59:16 1357-62.
44. Smith-Hanrahan C. Salivary kallikrein output during the stress response to surgery // Can. J. Physiol. Pharmacol. 1997. 75 (4): 301-304.
45. Okumura T., Nakajima Y., Matsuoka M. et al. Study of salivary catecholamines using fully automated column-switching high-performance liquid chromatography // J. Chromatogr. Biomed. Appl. 1997. 694 (2): 305-316.
46. Kirschbaum C., Wust S., Hellhammer D. Consistent sex differences in cortisol responses to psychological stress // Psychosom. Med. 1992 54:6 648-57.
47. Лукаш А.И., Зайка В.Г., Милютина Н.П., Кучеренко А.О. интенсивность свободно-радикальных процессов и активность антиоксидантных ферментов в слюне и плазме человека при эмоциональном стрессе. Вопросы медицинской химии. 1999. 45:6. 503-513.
48. Martin R.B., Guthrie C.A. Pitts C.G. Emotional crying, depressed mood, and secretory immunoglobulin A // Behav. Med. 1993. 19 (3): 111-114.
49. Hucklebridge F., Lambert S., Clow A., Warburton D.M., Evans P.D., Sherwood N. Modulation of secretory immunoglobulin A in saliva; response to manipulation of mood // Biol. Psychol. 2000. 53 (1): 25-35.
50. Evans P., Bristow M., Hucklebridge F., Clow A., Walters N. The relationship between secretory immunity, mood and life-events // Br.J.Clin.Psychol. 1993. 32 ( Pt 2): 227-236.
51. Stephen B. P. Quantitative aspects of stress-induced immunomodulation. International Immunopharmacology, 2001, 1:3:507-520.
52. Grander D.A., Weisz J.R., Kauneckis D. Neuroendocrine reactivity, internalizing behavior problems, and control-related cognitions in clinic-referred children and adolescents // J. Abnorm. Psychol. 1994. 103 (2): 267-276.
53. Kirkpatrick S.W., Campbell P.S., Wharry R.E. Robinson S.L. Salivary testosterone in children with and without learning disabilities // Physiol. Behav. - 1993. 53 (3): 583-586.
54. Davies R.H., Harris B., Thomas D.R., Cook N., Read G., Riad-Fahmy D. Salivary testosterone levels and major depressive illness in men // Br.J. Psychiatry. 1992. 161: 629-632.
55. Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. 1970. 227: 680-685.
56. Kusakabe T., Matsuda H., Gono Y., Kawakami T., Kurihara K., Tsukuda M., Takenaka T. Distribution of VIP receptors in the human submandibular gland: an immunohistochemical study // Histol. Histopathol. 1998 13:2 373-8.
57. Matsuda H., Kusakabe T., Kawakami T., Nagahara T., Takenaka T., Tsukuda M. Neuropeptide-containing nerve fibres in the human parotid gland: a semiquantitative analysis using an antibody against protein gene product 9.5 // Histochem. J. 1997 29:539-44.
58. Kawaguchi M., Yamagishi H. Receptive systems for drugs in salivary gland cells // Nippon Yakurigaku Zasshi 1995 105:5 295-303.
59. Dawidson I., Blom M., Lundeberg T., Theodorsson E., Angmar-Mansson B. Neuropeptides in the saliva of healthy subjects // Life Sci. 1997 60:4-5 269-78.
60. Beck-Sickinger A.G. Structural characterization and binding sites of G-protein-coupled receptors // DDT, V. 1, № 12, P. 502-512.
61. Уланова Е.А., Григорьев И.В., Новикова И.А. Гемато-саливарные механизмы регуляции в ревматоидном артрите. Терапевтический архив. 2001 73:11 92-4.
62. Won S., Kho H., Kim Y., Chung S., Lee S. Analysis of residual saliva and minor salivary gland secretions // Arch. Oral. Biol. 2001 46:619-24.
63. Wang P.S., Bohn R.L., Knight E., Glynn R.J., Mogun H., Avorn J. Noncompliance with antihypertensive medications: the impact of depressive symptoms and psychosocial factors // J. Gen. Intern. Med. 2002 17:7 504-11.







